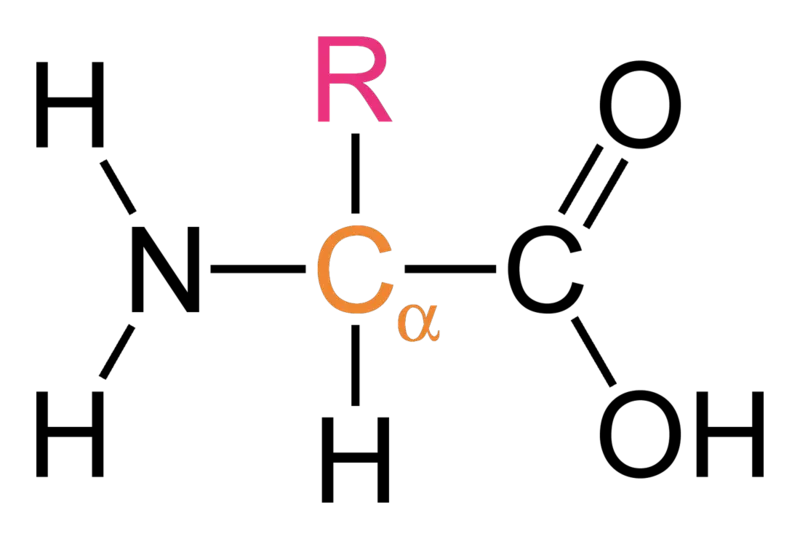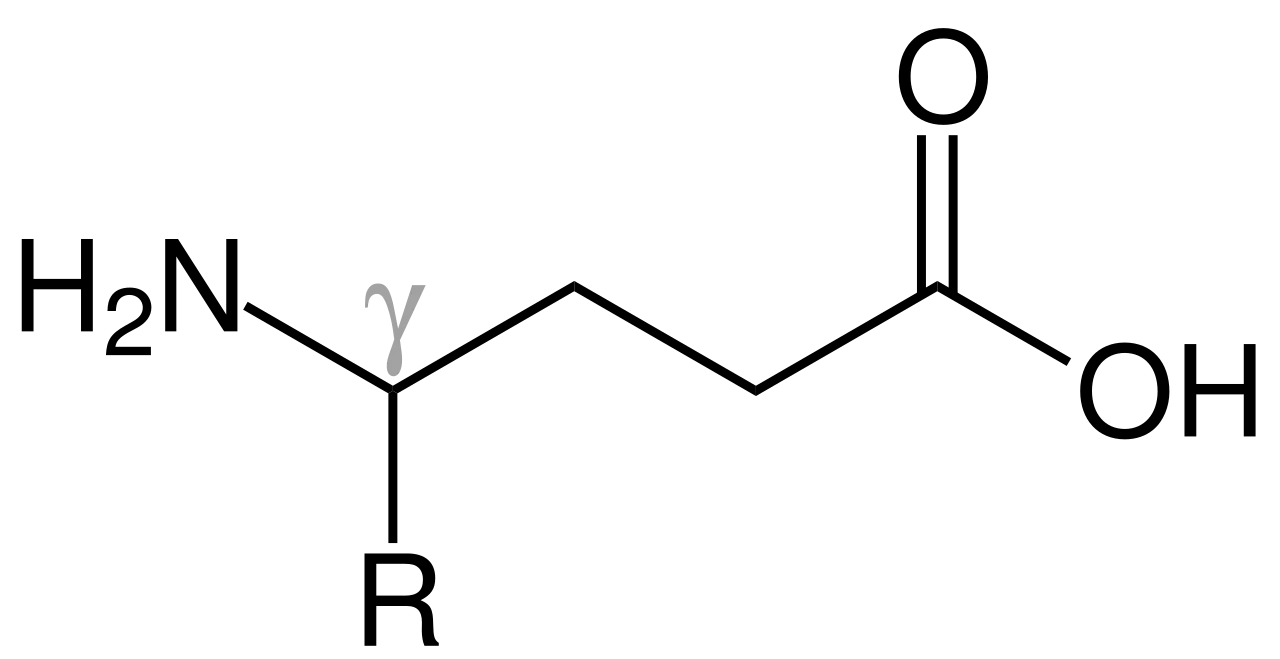Next-generation peptides and peptidomimetics
Peptide drug의 단점
1.
Poor plasma stability → 오랜 시간동안 남아 target에 binding하여 기능하기 어렵다.
2.
Poor membrane permeability → Intracellular target에 binding하기 어렵다.
Peptidomimetics란?
peptide의 properties를 improve하기 위해서 stabilization하고 non-natural scaffolds로 conversion한 것.
Peptidomimetics는 보통 4개의 class로 분류 (Class A, B, C, and D)
Class A와 B는 peptide의 성격이 strong함.
Class C와 D는 small molecule을 포함함.
Cyclic peptides, stabilized turns, and loops
•
Cyclic peptides
◦
cyclic해서 proteases에 덜 노출되어 stability가 높음.
•
Stabilized turns and loops
◦
Large libraries가 존재해 high-throughout screening으로 다루기 쉬움.
◦
예시) Ensemble Therapeutics (하버드 교수가 2004년에 설립함. Pfizer 등의 기업들도 승인하에 사용 중)
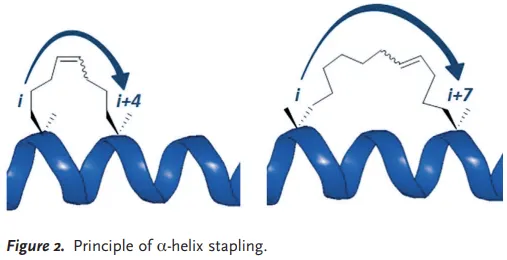
Stabilized -helices and -sheets
protein-protein interfaces에서 binding motifs의 가 -helices → 따라서 이 구조를 mimic하고 stabilize하는 데에 focus가 되었었음.
•
Hydrocarbon-stapled peptides
◦
cross-linking and -methylation → helicity를 increase
1.
Staple이 target protein과 interact하는 경우
2.
Staple이 peptide/protein interface에 위치하는 경우
3.
Staple이 protein binding에 참여하는 경우
•
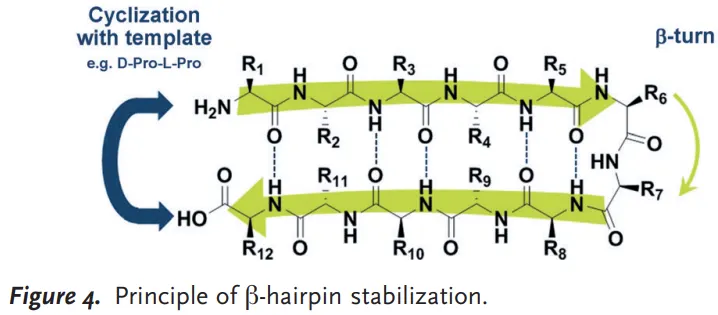
Macrocyclic -hairpins
◦
macrocyclization of the N- and C-terminus (+ side chain to side chain bridges)
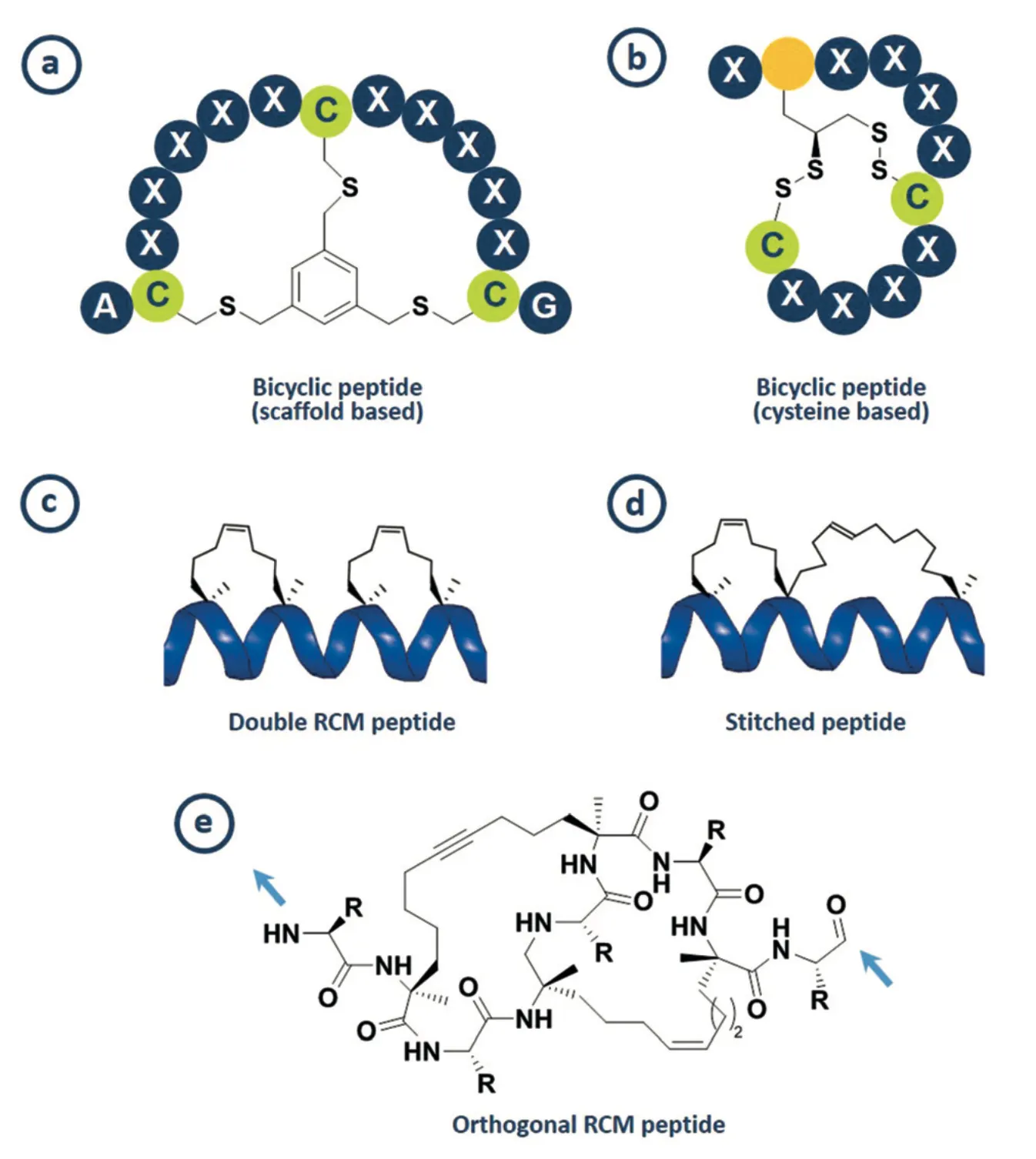
Bicyclic scaffolds
•
Bicyclic scaffold는 conformational rigidity를 가짐 → Target affinity / specificity를 증가시킴. → Antibody의 대안으로 제시되고 있음.
•
Bicyclic peptide의 예시.
a) Cyclization을 유도하는 scaffold를 사용하는 bicyclic peptide.
b) Cysteine끼리의 disulfide bond를
c) Ring-closing metathesis (RCM)을 활용하여 독립적인 두 개의 macrocycle을 만듦. Helicity가 비약적으로 향상된다고 함.
d) c)와 유사하지만 Macrocycle이 서로 맞붙어있음. 더 안정적이고, cellular uptake도 더 잘 된다고 함. 하지만 Therapeutic application은 아직 보고되지 않음.
e) RCM을 활용해서 동시에 2개의 macrocycle을 만드는 방법은 regioselectivity를 유발하여 문제가 있다. (선호되는 지역이 있겠지만, 어디에 cycle이 만들어질지 모르고 확률적으로 만들어짐.) 대신 orthogonal한 두 개의, ring-closing alkyne and olefin metathesis를 활용해서 bicyclic peptide를 만듦으로써 이를 해결함.
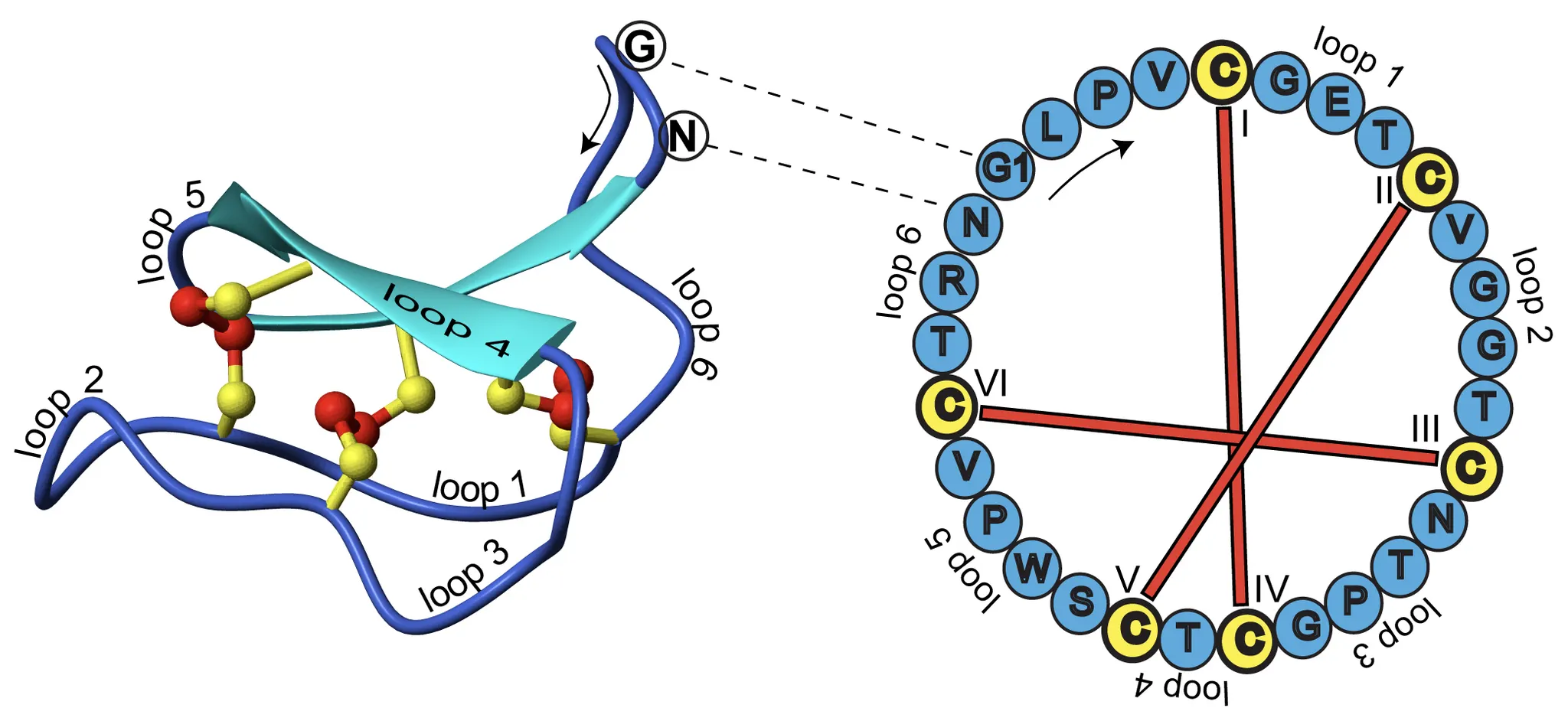
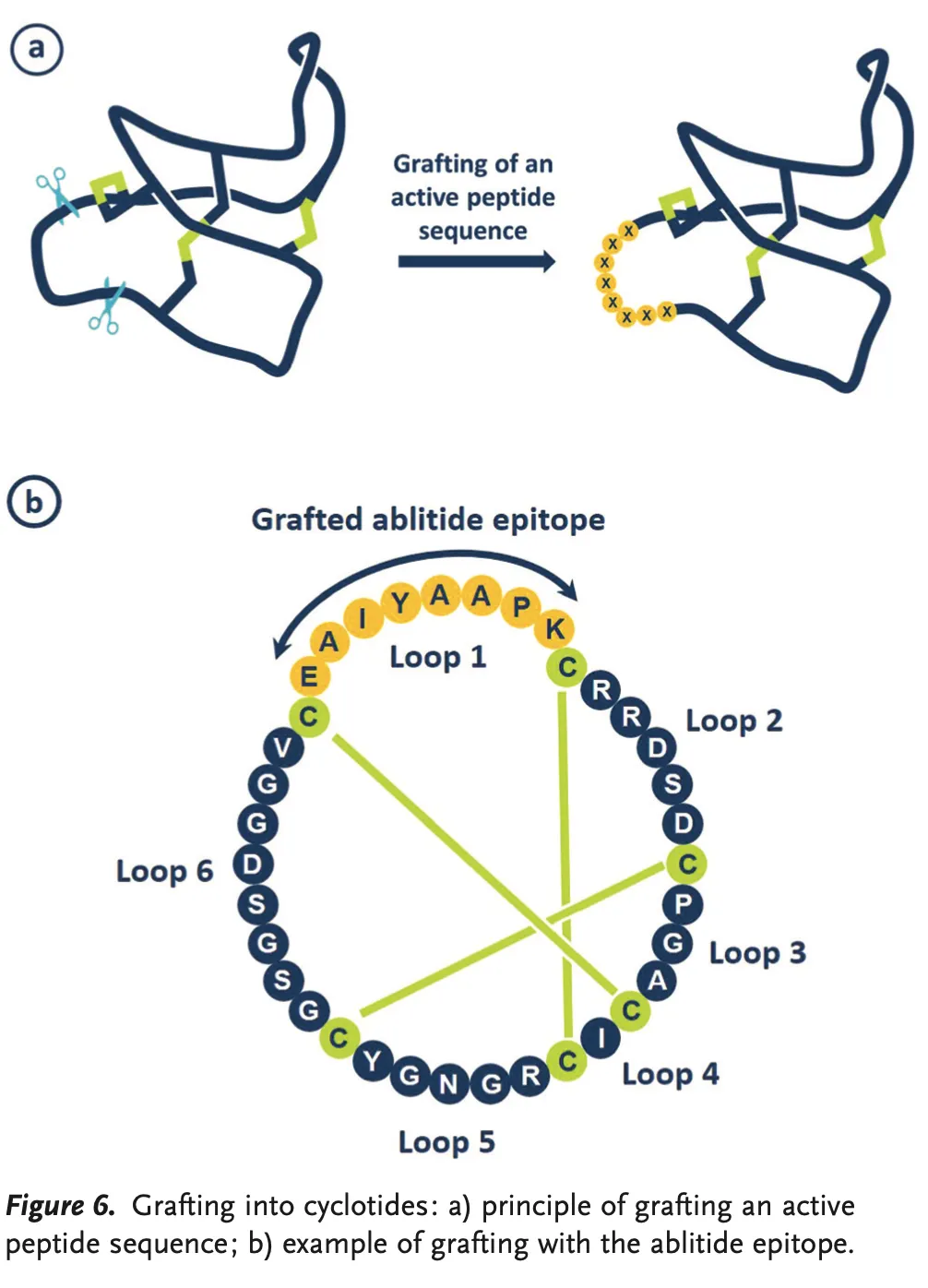
Cysteine-rich peptidic scaffolds
구조적으로 안정적인 cyclotide loop을 골격으로 두고, 일부를 bioactive 한 (e.g., Target과 결합한다고 알려진) 아미노산 서열로 치환함. (Grafting의 개념)
•
Cyclotide
◦
식물에서 유래한 disulfide-rich peptide. 보통 28-37개의 아미노산을 가짐. 많이 연구됨.
•
Grafting
← 왼쪽 그림의 노란 부분에 원하는 아미노산 서열을 집어 넣음으로써 target 단백질에 binding하는 등 원하는 기능을 하도록 만든다.
Peptide foldamers
•
자연적인 peptide처럼 -amino acid만을 building block으로 사용하는 것이 아니라, -amino acid, -amino acid, oligourea 등 다양한 buliding block을 -amino acid와 함께 사용한다.
◦
-amino acid: 일반적인 아미노산들이 이에 해당함. C 에 아민기(NH2), 카르복시기(COOH)가 달려 있는 구조.
◦
-amino acid:
◦
-amino acid
•
이렇게 색다른 buliding block을 잘 조합해서 사용하면 secondary structure가 매우 우세한 oligomeric structure를 만들어 낼 수 있다.
•
또한 이렇게 변형된 아미노산들을 사용하면 proteolytic stability가 증가한다고 알려져 있다.
◦
예시)
•
Hybrid peptide macrocycles
Relatively short peptide sequence + small-molecule entity
center에 큰 cycle 구조를 가짐.
Summary and perspective on peptides and peptidomimetics
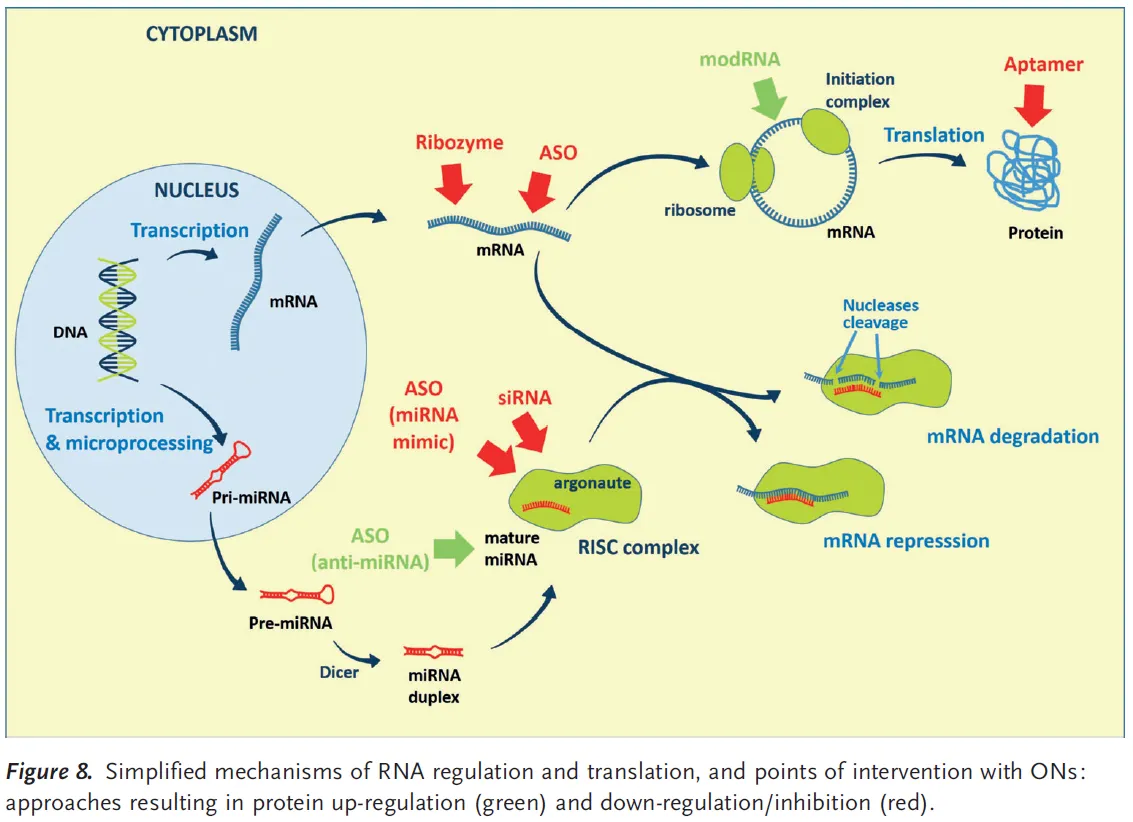
Oligonucleotides (ONs)
Classes and mechanisms of oligonucleotides
•
ON의 종류로는 ASO, siRNA, ribozyme, aptamer, modRNA 등이 있다.
•
mRNA modulation by ONs
◦
ASO와 siRNA는 mRNA에 상보적으로 결합. 각각 mRNA repression 및 degradation 유발
▪
ASO 및 siRNA와는 반대로, modRNA (modified RNA)는 enable translation.
•
(참고) protein modulation by ONs
◦
aptamer 및 immunomodulatory ON은 protein에 직접 결합. (ON으로 mRNA만 modulation할 수 있는 게 아님)
Antisense oligonucleotides (ASOs) and small interfering RNA (siRNA)
•
ASO: 16~20 nucleotides (단일 가닥).
◦
target RNA에 상보적으로 결합해 (1) RNA의 기능을 억제하거나 (2) nuclease에 의한 RNA의 분해를 촉진
◦
target RNA of ASO
▪
mRNA: ASO가 target mRNA의 번역을 억제한다.
▪
miRNA: mRNA의 분해를 유도하는 miRNA가 ASO에 의해 억제되기 때문에, 결과적으로 mRNA의 번역이 촉진된다.
▪
ASO itself can be used as a synthetic miRNA: protein translation 억제.
◦
각각의 miRNA는 여러 개의 mRNA에 결합할 수 있기 때문에, ASO가 mRNA 가닥 하나를 target하는 것보다 miRNA를 target하는 게 한꺼번에 더 많은 protein들을 regulate할 수 있다.
•
siRNA: 20~25 nucleotides (이중 가닥)
◦
double-stranded RNA (dsRNA)의 구조를 갖는다. (passenger strand + guide strand)
◦
Gene silencing
◦
siRNA의 작용 원리
▪
dicer (가수분해효소)가 passenger strand를 분해 → guide strand가 RISC complex에 결합 → RISC complex가 mRNA를 타겟팅 → mRNA를 분해함으로써 번역 억제.
◦
short hairpin RNA (shRNA)
▪
두 상보적인 oligonucleotide strands를 loop를 이루게 link한 것으로 (hairpin 구조), dicer에 의해 processed되어 siRNA가 만들어짐
Ribozymes and gene editing
Ribozyme이란?
Specific한 target RNA의 cleavage를 촉매할 수 있는 enzyme-like activity를 가지는 RNA
•
Ribozyme은 nucleases에 의한 degradation에 취약하기 때문에 chemical modification이 필요한데, catalytic activity를 해치면 안 되기 때문에 3차원 구조에 영향이 없도록 해야 함.
•
Gene editing (or replacement)
◦
CRISPR-Cas9 이용
▪
guide RNA: target gene(DNA)에 상보적. Cas9을 target gene으로 이끄는 역할
▪
Cas9: enconuclease. DNA를 자름.
◦
guide RNA & Cas9 gene을 포함하는 plasmid를 cell에 도입하는 방식
◦
최근에는 knock-out/knock-down 뿐만 아니라 gene activation도 가능하다고 함.
Modified RNA (modRNA)
•
원하는 protein을 coding하는 mRNA를 cell에 도입하여 in situ translation을 의도하는 방식
◦
Immune response를 줄이기 위해 chemically modified.
▪
uridine-5′-triphosphate → pseudouridine-5′-triphosphate
▪
cytidine → 5-methylcytidine
◦
VEGF-A를 coding하는 modRNA
▪
myocardial infarction 후의 heart function을 improve함. (mice 실험)
▪
diabetic wound healing, ischemic vascular diseases, heart failure가 있는 환자에게 regenerative treatment로 사용하려는 clinical trials이 시작됨.
Protein recognition with aptamers
Aptamer란?
안정적인 3차원 구조를 형성하며, target molecule (e.g., protein)에 specific하게 binding하여 기능을 조절하는 single-stranded oligonucleotides.
•
사례: pegaptanib (Macugen)
◦
age-related macular degeneration 치료제
◦
VEGF에 결합
•
Aptamer가 stable한 구조를 형성한다고는 하지만, unmodified aptamer의 half-life는 매우 짧음. (nuclease에 취약)
◦
Nuclease는 high enantioselectivity를 보인다고 하는데, 이를 활용하는 방법이 있음.
▪
enantiomer: 거울상 이성질체
◦
거울상 이성질체로 modify (e.g., D-ribose → L-ribose)
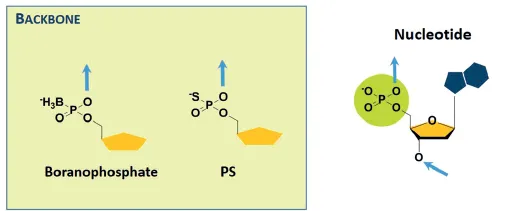
Chemical modifications of oligonucleotides
Design and properties of oligonucleotides (ONs)
•
자연적인 상태의 ON들은 nuclease들에 의해 phosphodiester backbone 결합이 끊어지기 때문에 불안정하다 (= 반감기가 짧다). 한편 ASO는 plasma protein들에 잘 결합하지 않아서 빠르게 배설되어 pharmacokinetic property가 좋지 않았다 (= 몸에서 빨리 제거됨).
•
ON의 안정성과 pharmacokinetic property를 개선하는 다양한 방법이 연구되어 왔다.
◦
예시) L-Ribonucleic acid aptamer (상표명 Spigelmer)
▪
자연 상태의 ON 들은 D-ribose로 만들어진다. L-ribose로 만들어진 ON은 따라서 자연 상태 ON의 거울상 이성질체(enantiomer)이다.
▪
Nuclease는 D-RNA를 더 잘 분해하므로, L-RNA인 Spigelmer는 nuclease에 의해 잘 분해되지 않는다.
•
특정 RNA를 target 하는 ON을 설계하는 건 쉬워 보인다 (상보적인 서열을 design하면 됨). 하지만 RNA는 secondary / tertiary 구조를 가져서, RNA의 모든 지역이 accessible한 것이 아니다. → 따라서 potent한 ON들을 선별하는 screening 과정이 필요하게 된다.
Backbone modification
•
Nuclease에 의한 ON의 분해를 막기 위해서, phosphodiester backbone을 다른 구조로 화학적으로 치환하려는 시도들이 많이 있어 왔다.
◦
예시) Phosphorothioate (PS) linkage
▪
PS backbone으로 바꾸면 nuclease resistance가 생기고, plasma protein에 더 잘 결합한다.
▪
또한 RNase H에 의한 target RNA의 분해를 촉진한다고 알려져 있다.
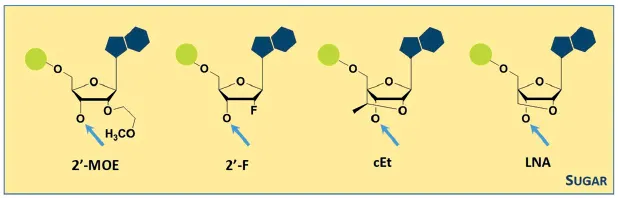
Modification of the sugar
•
Ribose의 2’-hydroxy group이 전기음성도가 큰 원자 (fluorine) 나 alkylated small group에 의해 치환된다.
•
Steric hindrance 결과, nucleases에 대한 resistance가 증가.
•
longer tissue half-lives and higher tissue bioavailability
•
exonucleases에 대한 안정성 증가와 감소된 proteins에 대한 unspecific한 결합에 덕분에 PS보다 less toxic함.
•
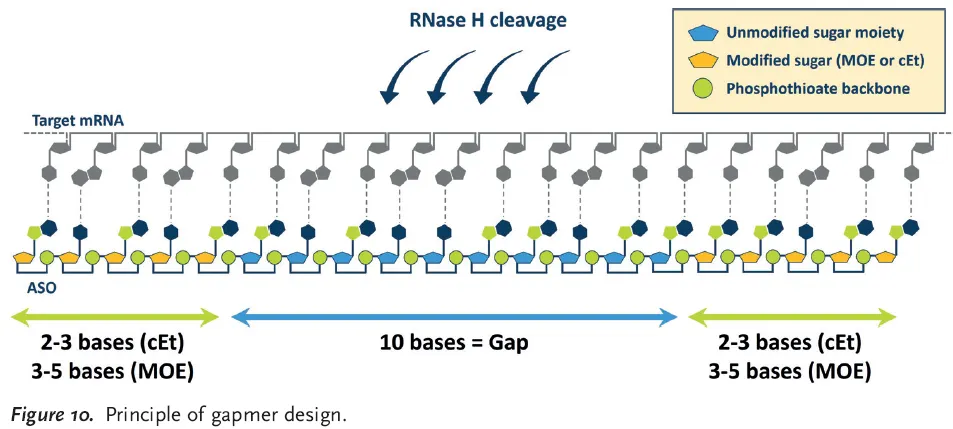
From stable ASOs to Gapmers
•
Sugar의 2’-position을 변형하는 것은 ASO의 안정성을 높이기도 하지만, ASO가 target하는 mRNA가 RNase H에 의해 분해되는 것도 막기 때문에 문제가 있다.
Gapmer란?
ASO의 일종으로, 양 끝 2~5 base들만 backbone modification 되어 있고 가운데 10 base는 modification이 되어 있지 않음. 따라서 안정성은 확보하되, 중간 10 base 지역에서 RNase H에 의한 cleavage가 일어날 수 있게 함.
Gapmer의 구조.
예시) mipomersen, AZD9150
•
mipomersen
◦
apolipoprotein B100을 만드는 mRNA를 target하여 cholesterol level을 감소시킴
•
AZD9150
◦
TF인 STAT3를 target함.
◦
STAT3는 다른 therapeutics로 inhibit하기 어려웠었다고 함.
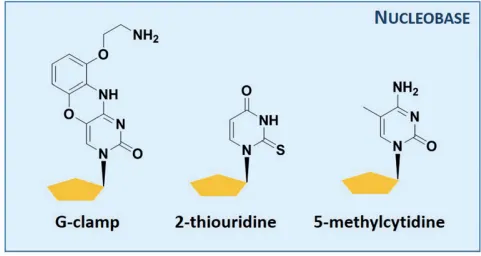
Modification of the nucleobases
•
ON-RNA 또는 ON-DNA complex의 안정성을 높이기 위해, ON에 altered nucleobase를 integrate
•
◦
modified purine보다 modified pyrimidine이 더 stable함
◦
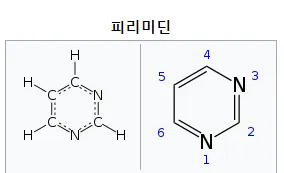
주로 쓰이는 modified pyrimidine: pyrimidine의 5번 탄소에 methyl group, thiazole, phenyl ring, propyne 등을 붙임 (C5 substitution of pyrimidine)
▪
pyrimidine:
▪
modified pyrimidine의 예시
◦
이렇게 modified nucleobase를 사용하면 nuclease resistance가 높아지고 안정성이 높아짐
▪
특히 헌팅턴 병과 같은 autosomal dominant disorder (상염색체에 위치한 dominant gene의 mutation으로 인해 발생하는 병)에서는 single gene mutation만으로도 발병할 수 있기 때문에, RNase H 의 activity를 조절하는 것이 특히 중요함.
•
RNase H: 가수분해를 통해 RNA의 절단을 촉매하는, endonuclease의 일종
•
이런 경우에는 drug가 wide-type allele은 건드리지 않으면서 mutated allele만 선택적으로 inhibit해야 함.
▪
(예시)Gamper ASO의 gap 부분에 2-thio and C5-triazolyl-phenyl-modified thymine을 넣은 것을 drug으로 사용한 결과, 헌팅턴 병 환자의 fibroblast에서 mutant allele이 억제됨.
•
(2) modified cytosine
◦
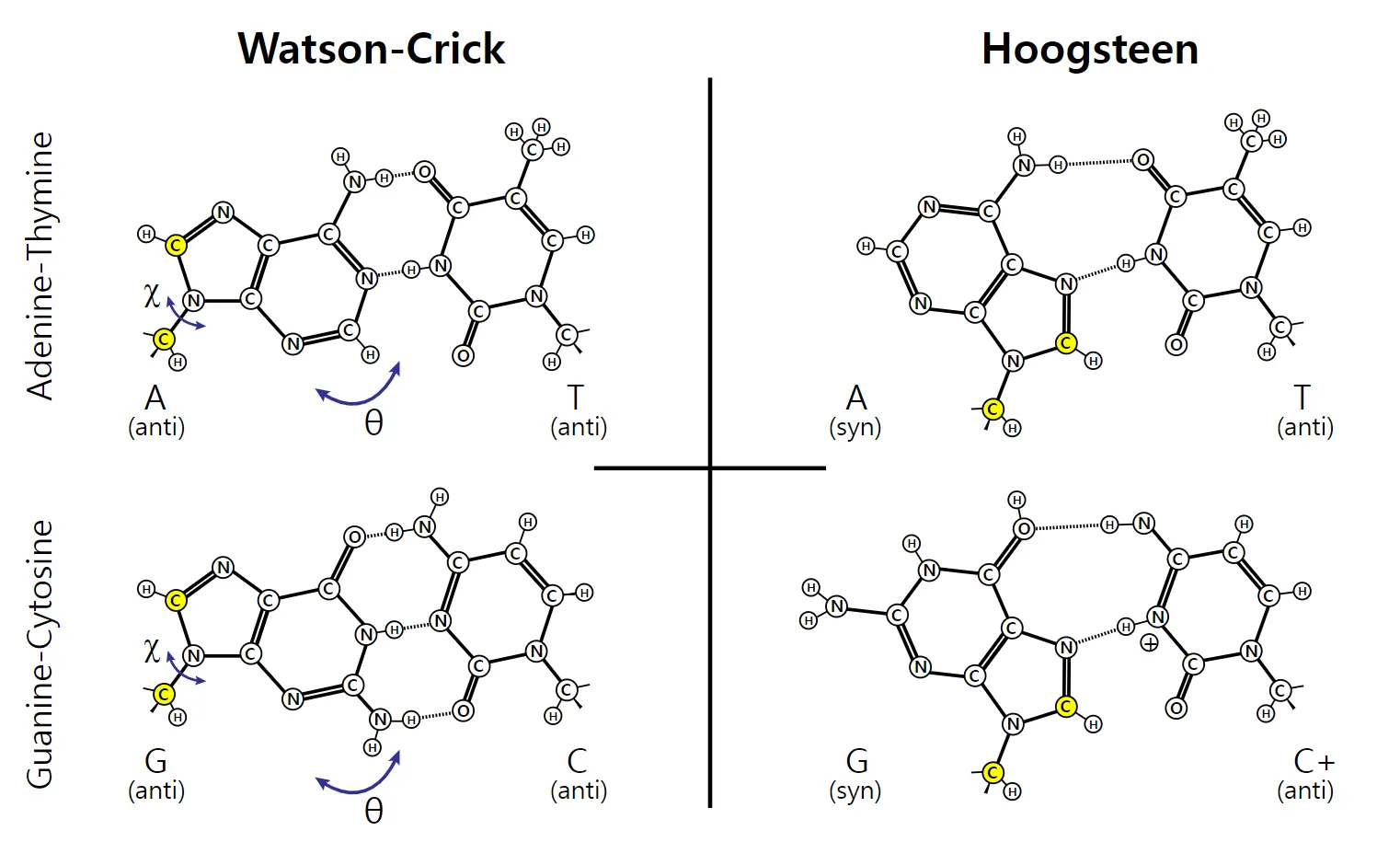
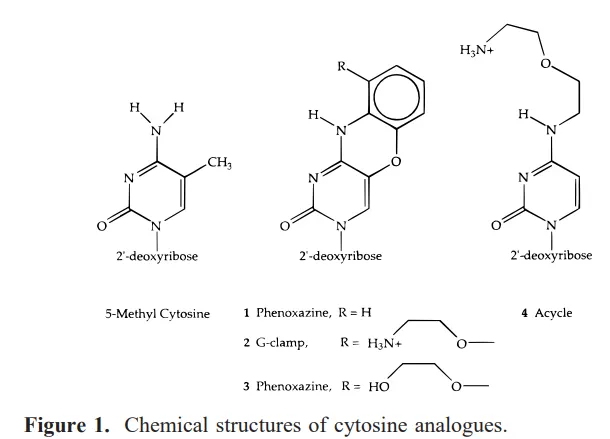
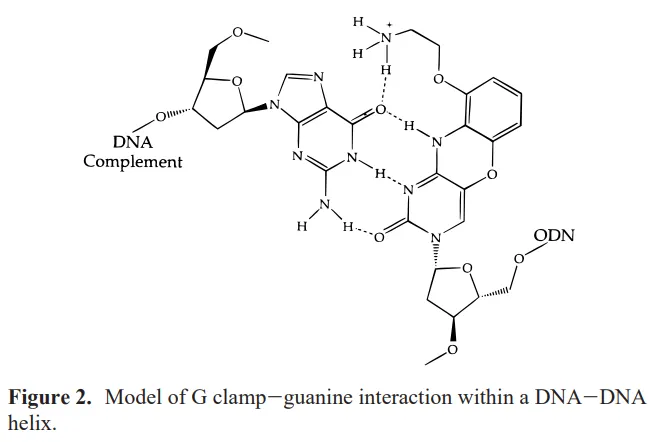
cytosine을 변형시켜서 (cytosine analogue), guanine과 cytosine analogue 간에 Watson-Crick base pairing 과 Hoogsteen base pairing이 동시에 생기도록 만듦.
▪
Hoogsteen base pairing
•
non-Watson-Crick base pair
•
(예시) Guanine의 6번 O와 cytosine의 7번 N 간에 bonding이 생기는 것.
▪
Chemical structures of some cytosine analogues
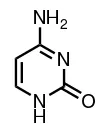
Cytosine
Cytosine analogues
▪
Cytosine analogue와 guanine 간에 Watson-Crick 및 Hoogsteen base pairing이 동시에 생긴 예시
기존에 Watson-Crick base pairing에서 관찰되는 guanine과 cytosine 간의 3중 수소결합 외에, Hoogsteen base pairing (guanine의 6번 O와 cytosine analogue의 N 간의 결합)이 추가로 생김.
◦
이렇게 하면 base pairing이 더 stable해진다.
•
(3) Introduction of modified nucleobases to modRNA
•
(4) naturally occurring modifications
◦
ex) 5-methylcytidine, pseudouridine
◦
이 예시들은 translation efficiency를 높이고, immune system의 activation을 낮춘다
Other modifications
•
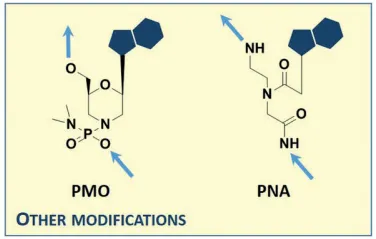
PMOs (phospohorodiamidate morpholino oligomers)
◦
morpholino ring과 phosphorodiamidate bond를 가지고 있음
◦
stable towards degradation by nucleases
◦
exhibit good target binding affinity
◦
backbone이 neutral해서 RNase H에 의해 cleavage가 안됨
◦
사례) eteplirsen (Duchenne muscular dystrophu 치료, FDA approved)
•
PNAs (peptide nucleic acids)
◦
nonproteinogenic peptidic backbone
◦
nucleases나 proteases에 의해 degrade되지 않음.
◦
limitations
▪
poor solubility
▪
low cellular uptake
◦
다른 modalities와 conjugate해서 사용해 drawbacks를 극복하려 함.
Summary and perspective on oligonucleotides
•
RNA를 modulate해서 therapeutic potential을 최대치로 끌어올리는 방법들이 아직 다 밝혀지지 않음
◦
ex) long noncoding RNAs의 역할
•
새로운 기술이 개발됨에 따라 ON-based therapeutics의 적용 범위 및 영향력이 빠르게 증가 중.
◦
5개 drug이 FDA-approved됨.
▪
ASO가 제일 많이 쓰임.
▪
ON의 backbone 또는 nucleobase를 modify해서 성능과 안정성을 높이고, 표적이 아닌 물질에 영향을 끼치는 것을 감소시킴 (off-target effects)
▪
실제 drug으로 쓰이는 예시들
•
Duchenne muscular dystrophia의 치료제 etiplersen
•
spinal muscular atrophy의 치료제 nusinersen
◦
ON-based therapeutics: modality의 chemical structure에 변화를 줘서 ON-small molecule/peptide conjugate의 delivery 능력을 높임.
▪
ON-based strategies의 예시
•
CRISPR-Cas9
•
modRNA
•
하지만 아직 therapeutic application 측면에서 개선해야 할 점이 많이 남아있음.
◦
ex) compound의 cellular uptake 메커니즘을 이해하고 성능을 높이는 것
▪
single-stranded ON (e.g., ASO)보다는 double-stranded ON (e.g., siRNA, modRNA)의 성능을 높이는 게 더 어렵다.
◦
ex) To enable oral delivery of ON-based therapeutics
▪
drug delivery 관련해서는 (a) target organ (e.g., lung, eye)로 pure RNA를 주입하는 방법부터 (b) lipid nanoparticle 또는 liposome을 vesicle로 사용해 RNA를 체계적으로 delivery하는 방법 등 여러가지 다양한 방법들이 개발되어 왔다.
▪
최근에 ASO를 사용한 실험에서는 delivery agent를 사용하지 않고도 ASO의 systemic eposure 및 intracellular effect 성능이 좋았음.
▪
ASO를 비롯한 ON-based drug의 potential을 더 잘 이해하려면 delivery technology에 대한 더 깊은 이해가 필요.
▪
ON drug들은 자연적으로 다른 조직들에 비해 liver, kidney, spleen으로 더 잘 distribute된다.
•
따라서, 만약 liver, kidney, spleen 이외의 target tissue로 ON drug을 전달하고자 한다면, efficacy를 내기 위한 충분한 약의 농도를 찾는 것이 challenging task가 될 것임
•
ON drug을 deliver할 수 있는 tissue 종류를 늘리려는 연구가 계속 진행 중임
•
위에서 말한 ON drug 관련 challenge들 (cellular uptake, systemic delivery, broadening tissue distribution)을 해결하기 위한 한 가지 제안은 ON-based drug을 carbohydrate, peptide, small molecule, aptamer와 같은 다양한 carrier (vesicle)들과 conjugate시키는 것이다.
◦
바로 다음 section인 ‘Mixed Modalities’와 이어지는 내용.
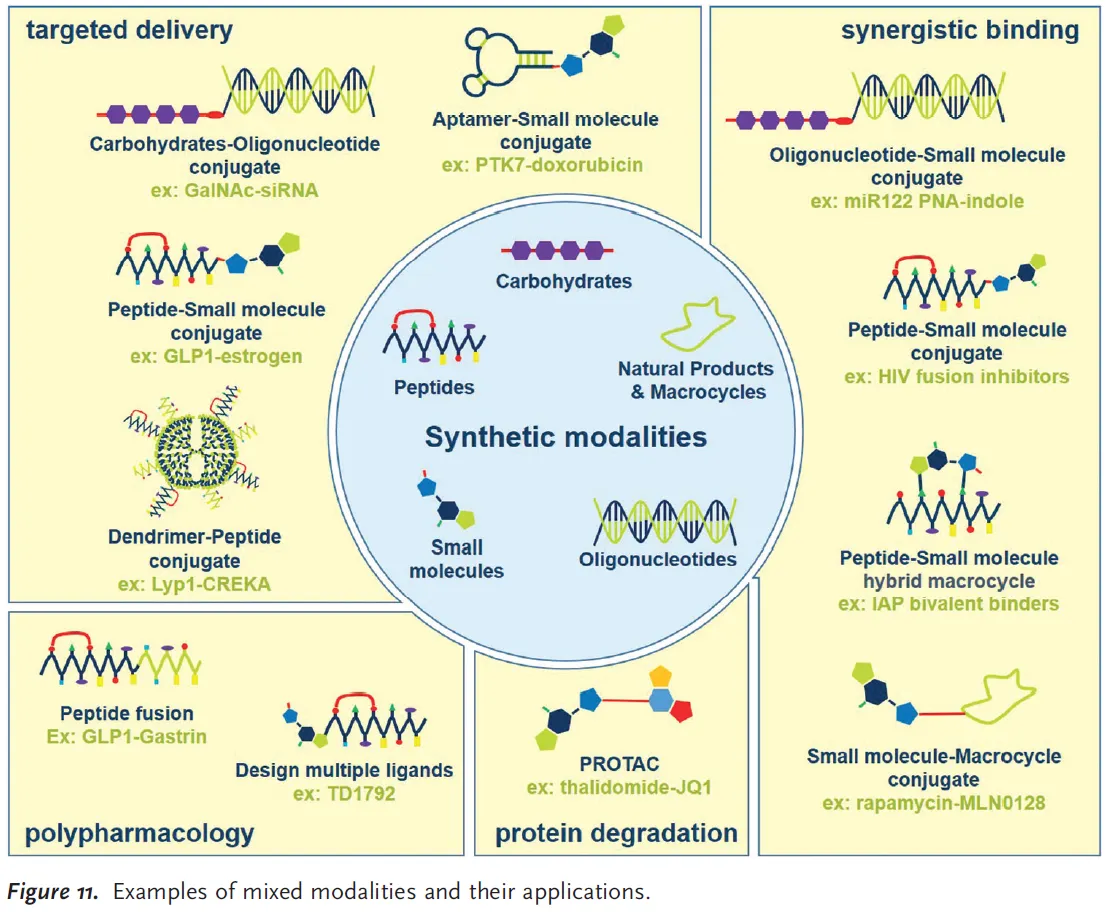
Mixed modalities
•
Intuition: 위에서 언급된 여러가지 modality들을 integrate/combine하여 new modality를 만들자
→ 각 unit의 장점들을 leverage할 수 있음.
•
Two classes of mixed modalities
1.
Fusion: 개별 entity들(figure 11의 ‘synthetic modalities’들)을 결합시켜 fused modality를 만듦
•
ex) figure 11의 peptide fusion
2.
Conjugate: 개별 entity들을 conjugate하여 molecular conjugate를 만듦. linking의 개념
•
ex) figure 11의 peptide-small molecule conjugate
•
새로운 modality와 linking함으로써 원래 modality의 pharmacological activity를 높이거나, 두 modality가 서로 synergize
Molecular conjugates for targeted delivery
•
주로 drug molecule (pharmacologically active molecule)과 homing molecule을 conjugate시킴
◦
homing molecule이 목표지점 (targeted tissue or cell)까지 drug molecule을 데려감.
◦
이 conjugate types는 target으로 하지 않는 다른 신체 부위에 대한 exposure은 minimize하면서, local concentration을 증가시키는 것을 목표로 하여, 궁극적으로 therapeutic window (치료 범위)를 넓히고자 함.
◦
ex) ADC (antibody-drug conjugates).
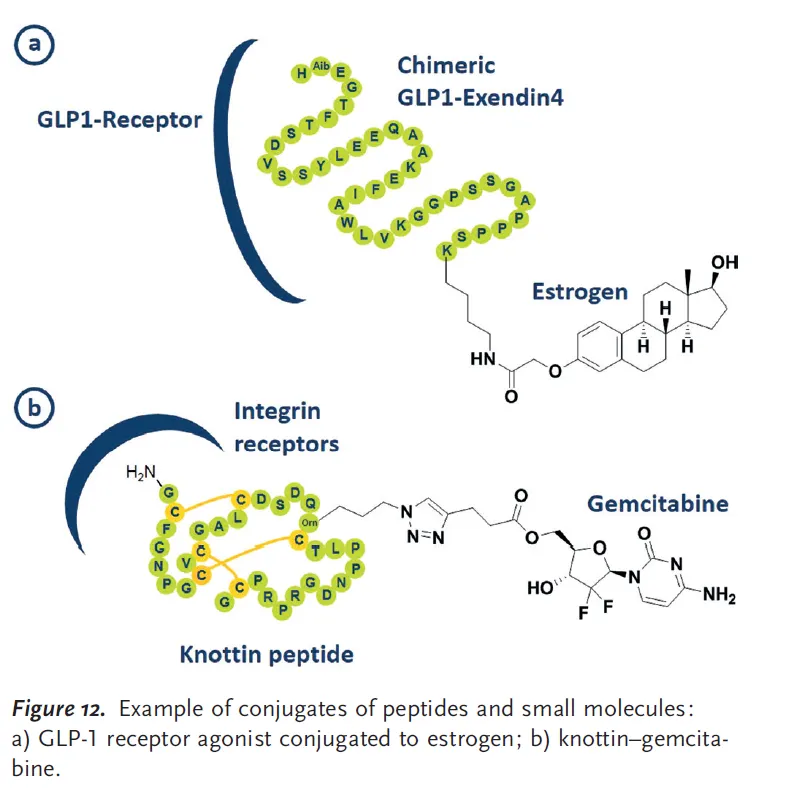
Conjugates of peptides and small molecules for targeted delivery
•
Drug molecule (hydrophilic, cytotoxic)을 cell-penetrating molecule (homing molecule)와 결합시켜 약물을 세포 내로 통과시키는 방법이 cancer therapy에서 주로 쓰인다.
•
대부분의 peptide/small-molecule conjugate에서는 peptide가 homing molecule로 쓰이지만, 100% 그런 건 아니다.
Peptide-small molecule conjugate의 예시. GLP-1 receptor agonist가 steroid(estrogen)에 conjugate되어 estrogen이 target cell (or tissue)에 도착할 수 있도록 유도함으로써 metabolic syndrome을 치료.
•
원리: homing molecule이 target cell의 세포막에 있는 receptor에 결합하면 drug molecule이 세포 내로 유입되어 작용.
•
최근에는 cyclic peptide-small molecule conjugate도 쓰이고 있다.
Oligonucleotide conjugates for targeted delivery
•
ON의 limitation:
◦
poor cell penetration (특히 siRNA) → can’t reach target cell
◦
모든 tissue에 대해 잘 작용하진 않음. 예를 들어 siRNA와 ASO는 liver와 kidney에 주로 작용.
•
이런 ON의 limitation을 극복하기 위해 conjugation to peptides, small-molecules, lipids, carbohydrates, aptamers 등이 쓰인다.
Lipid-oligonucleotides conjugates
•
background: ON은 highly negatively charged이기 때문에 cell permeation 능력이 좋지 않음
•
해결책: ON을 lipid와 conjugate시켜서 lipophilicity를 높이고 lipoprotein-mediated endocytosis를 유도.
•
ON에 주로 conjugate되는 lipophilic molecule로는 cholesterol, cholic acid, lauric acid, palmitic acid 등이 있다.
•
lipid-ON conjugate 예시: PS-ASO, -tocopherol linked to siRNA
◦
그냥 ASO만 썼을 때보다 PS-ASO conjugate을 썼을 때가 target cell (liver Kupffer cell)의 ASO uptake가 5배 더 높았다.
◦
-tocopherol을 siRNA에 conjugate시킨 결과, 이 siRNA가 타겟팅하는 mRNA의 level이 down-regulated되는 게 확인됨.
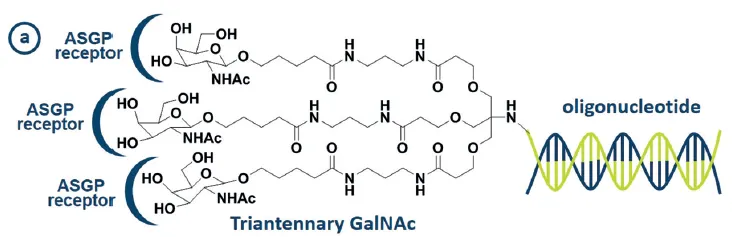
Carbohydrate-oligonucleotides conjugates
•
carbohydrate (sugar) 를 siRNA에 conjugate시키면, sugar가 세포 표면의 asialoglycoprotein receptor와 결합하여 siRNA가 strong knockdown of target gene을 유발할 수 있게 한다.
◦
예시) siRNA를 glucose, galactose, N-acetylgalactosamine 등의 carbohydrate과 conjugate
Figure 13(a).
그냥 ON만 썼을 때보다 tri-antennary GalNac-ON을 썼을 때가 화합물이 더 stable하며 efficacy도 더 높다.
Tri-antennary GalNac-ASO를 썼을 때가 그냥 ASO만 썼을 때에 비해 target cell (mice hepatocytes) 로의 ASO uptake가 증가하여 ASO의 효과가 10배 더 높았다는 연구결과가 있었다.
•
carbohydrate을 ON과 conjugate시킴으로써 얻는 효과:
◦
improved efficacy (or potency)
◦
increased uptake of ON into target cell
◦
more effective receptor-mediated endocytosis
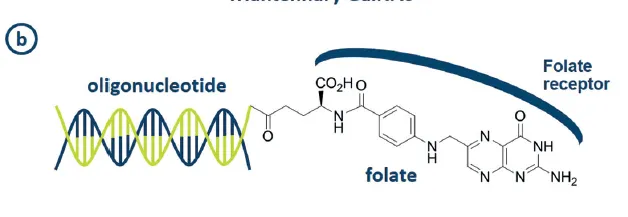
Small-molecule/oligonucleotides conjugates
•
examples: anandamide-siRNA, flavin-PNA, anisamide-ASO, folate-siRNA
Figure 13(b)
•
주의해야 할 점
◦
(1) target cell 표면에 small-molecule과 결합하는 receptor가 충분히 많이 있는가?
▪
그렇지 않으면, ON을 small-molecule과 conjugate시켜도 ON이 세포 내부로 잘 uptake되지 않을 수 있다.
◦
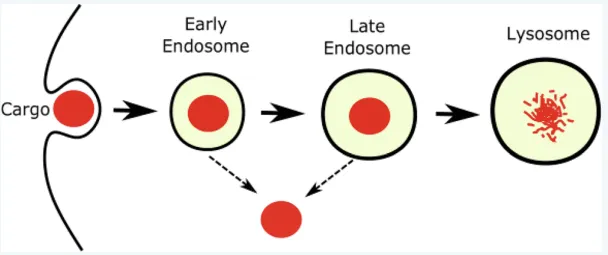
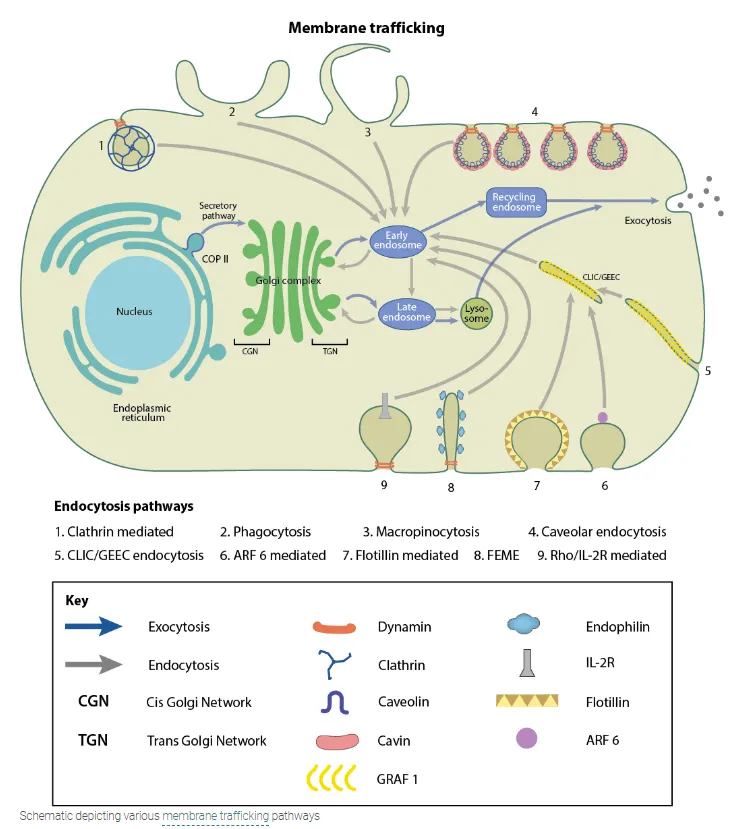
▪
biological agent가 세포 밖에서 세포 안으로 유입될 때는 주로 endocytosis를 통해 들어온 후, early endosome을 형성한다. 시간이 지남에 따라 early endosome은 late endosome이 되고, late endosome이 lysosome과 결합함으로써 결국 endosome 내부의 물질이 가수분해된다 (endosomal-lysosomal system).
•
early endosome과 late endosome을 나누는 기준: pH. (각각 ~6.3, ~5.5)
•
endocytosis: 세포 밖의 분자가 세포막으로 둘러싸여서 세포 내로 유입되는 것. 유입되는 분자가 극성 분자일 경우 소수성 세포막을 통과하기 어렵기 때문에 많이 쓰임.
•
lysosome: 각종 가수분해 효소들이 들어 있는 세포 내 소기관
▪
따라서, small molecule - drug molecule conjugate가 endosome을 빠르게 탈출해서 cytosol 영역에 도달해야 약으로서의 실제 작용을 할 수 있다(endosomal escape).
▪
small molecule - siRNA conjugate의 경우, 이 conjugate가 endosomal trapping되면 siRNA가 타겟팅하는 gene의 silencing이 일어나지 못한다.
▪
실제로 endosomal escape은 drug delivery field에서 활발하게 연구되고 있는 분야 중 하나이다.
실선: endosomal-lysosomal system (endosomal-entrapped cargo).
점선: endosomal escape.
(reference: https://pubs.acs.org/doi/pdf/10.1021/acs.bioconjchem.8b00778)
Peptide-oligonucleotides conjugates
•
주로 CPP (cell-penetrating peptide)를 ON과 conjugate시킨다.
◦
CPP: short peptides (< 30 amino acids). 자기 자신을 세포 외부에서 내부로 translocate 시킬 뿐만 아니라, 자기 자신과 conjugate되어 있는 drug (or cargo) 또한 translocation 시킨다.
◦
•
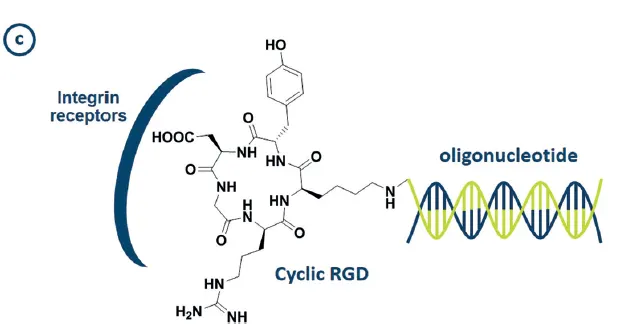
peptide-ON conjugate의 몇몇 예시: cRGD - luciferase siRNA, bombesin - ASO
Figure 13(c).
cRGD 외에도, D-peptide analogue of insulin-like growth factor 1, fusion peptide of an arginine-rich sequence and a muscle-targeting heptapeptide sequence 등의 targeting peptide들이 쓰임
•
효과: 그냥 ON만 썼을 때보다, peptide-ON을 썼을 때가 target cell로의 uptake가 더 많이 됨.
•
Limitation: ON과 conjugate되는 peptide들 중, 독성을 띠는 것들이 있음.
◦
보통 peptide-ON conjugate는 high dose로 사용하는 경우가 많은데, 이럴 때 peptide가 유발하는 cell toxicity가 문제가 될 수 있다.
◦
이를 해결하려면 CPP의 internalization 기작에 대한 더 깊은 이해를 통해, peptide-ON conjugate를 lower dose로 사용해도 효과가 있게 만들어야 함.
Aptamer conjugates
•
aptamer는 folding property를 가지고 있기 때문에, receptor에 대한 recognition motif로 활용될 수 있는 potential이 높다.
•
위의 예시들과는 달리, ON 외에 다양한 molecule들과 conjugate시킬 수 있다. (e.g., peptide)
•
예시:
◦
PTK7-targeting-aptamer - (hydrazone (linker)) - doxorobucin (drug)
▪
이 conjugate가 endosome의 형태로 세포 내로 유입된 후 endosome 내부에서 linker가 cleave되어, drug을 cytoplasm에 노출시킴.
◦
CD28-targeting aptamer - P60
▪
P60 inhibits Foxp3 expression.
▪
mouse colon carcinoma model로의 vaccination을 통해 conjugate의 효과 확인
•
P60 alone:
◦
low dose (125pmol) everyday: not working (tumor growth에 영향 못 줌)
◦
high dose (50nmol) everyday: working
•
CD28-targeting aptamer - P60 conjugate:
◦
low dose (125pmol) everyday: working
→ aptamer-P60 conjugate has more vaccine efficacy.
◦
PSMA-targeting aptamer - siRNA
▪
PSMA: prostate-specific membrane antigen
•
Linker (or spacer): increase safety and stability of peptide-drug conjugate.
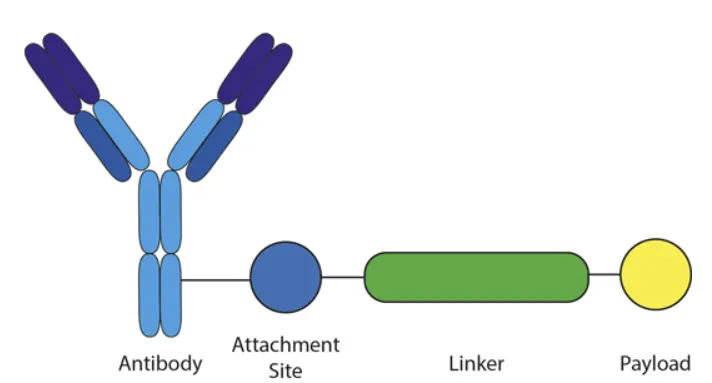
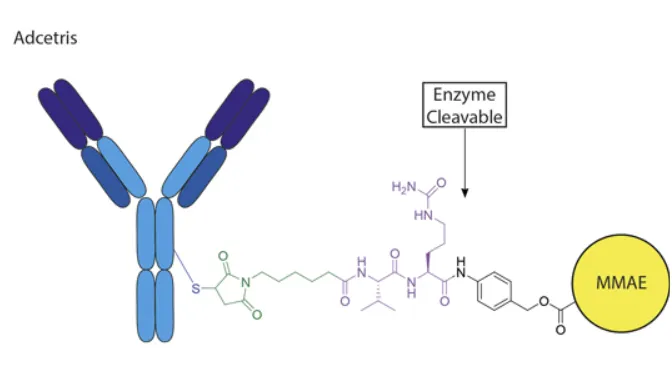
Three major components of antibody-drug conjugate (ADC): antibody, linker, payload to be delivered.
Antibody, linker, payload 가 각각 이 section에서 언급된 homing peptide (cargo를 target cell까지 데려가는 peptide), linker, drug molecule (could be ON or any other molecule-of-interest)라고 이해하면 될 것 같음.
(그림 출처: https://broadpharm.com/blog/what-are-adc-linkers)
•
cleavable linker: linker 중에서도, 특정 chemical signal (e.g., exposure to specific enzyme, acidity, intracellullar reducing of specific chemical)에 의해 cleavage될 수 있는 것을 cleavable linker라 한다. Linker가 cleavage되면서, conjugate 형태로 존재하던 peptide와 drug molecule이 서로 분리되고 drug molecule이 세포 내에서 효과를 낼 수 있다.
Example of antibody-drug conjugate (ADC) which contains a cleavable linker.
Adcetris with enzymatically cleavable val-cit linkage.
(그림 출처: https://broadpharm.com/blog/what-are-adc-linkers)
•
non-cleavable linkers (예: SMCC): linker가 세포 내에서 lysosome에 의해 가수분해되어야 drug molecule이 peptide - drug conjugate로부터 분리되어 세포 내에서 효과를 낼 수 있다.
Approaches for synergistic binding
•
motivation: single modality만으로는 affinity 또는 selectivity가 부족한, challenging target들이 존재 → 여러 synthetic modality들을 합쳐서 더 다양한 molecule structure를 만들자
•
synergistic binding을 위한 mixed modality 사용
Peptide-based approaches
•
(1) conjugating different modalities (e.g., peptide - small-molecule conjugate)
◦
예시:
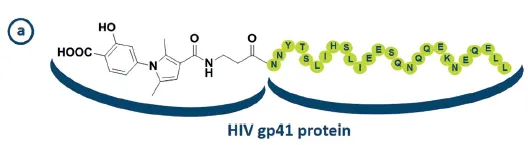
Figure 14 (a) HIV fusion inhibitor targeting the gp41 protein.
- HIV fusion inhibitor: Inhibitors of the fusion of HIV to host cells, preventing viral entry.
- gp41: HIV의 envelope protein complex의 subunit. (glycoprotein 41)
▪
gp41 domain에서 small-molecule HIV fusion inhibitor의 binding pocket 근처에 peptidic HIV fusion inhibitor의 binding pocket도 있다.
•
peptide inhibitor와 small-molecule inhibitor의 conjugate을 사용하자 (synergistic)
•
위의 그림도 peptide inhibitor와 small-molecule inhibitor의 conjugate을 묘사한 듯
•
conjugate inhibitor를 사용한 결과, low dose (low nanomolar) 만으로도 여러 HIV-1 strain에서 HIV fusion inhibition 효과를 낼 수 있었다.
◦
peptide inhibitor 또는 small molecule inhibitor 단독으로 쓸 경우에는 low micromolar dose ( >> low nanomolar) 가 필요하다 함.
•
(2) fusing different modalities
◦
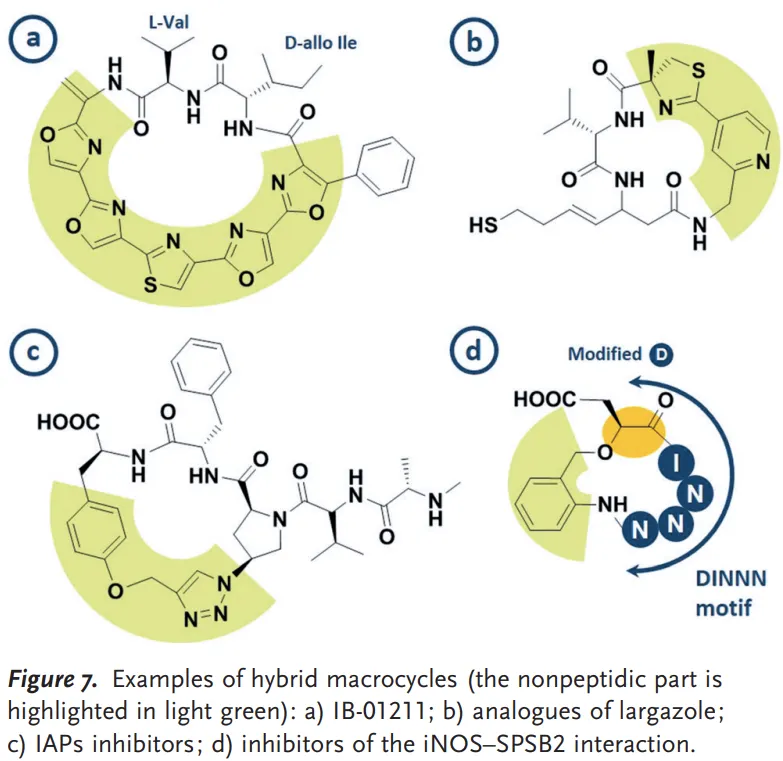
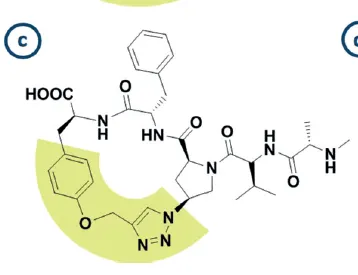
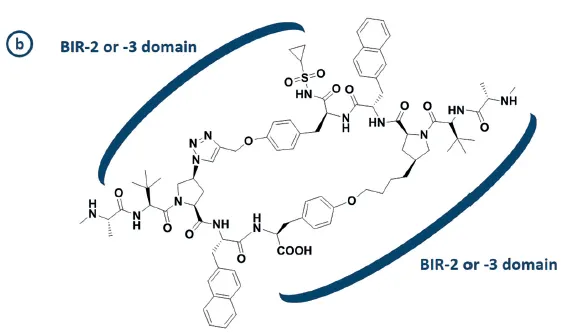
예시: IAP protein의 inhibitor (아래 그림)를 두 개 fuse해서 하나의 분자로 만듦
Figure 7(c). IAP inhibitor (macrocycle)
▪
위 그림의 macrocycle은 원래 XIAP protein의 BIR-2 또는 BIR-3 domain에 결합
▪
XIAP protein에서 BIR-2와 BIR-3 domain은 매우 가까이 위치해 있음
▪
Intuition: 그러면 위의 macrocycle 두 개를 fuse해서, BIR-2와 BIR-3에 동시에 결합하는 one epitope을 만들자
Figure 14(b). Bivalent IAP inhibitors binding to two different domains simultaneously.
•
이 방법으로 실험했더니, fuse 안 했을 때에 비해 (1) binder로서의 potency (적은 농도만으로도 BIR domain에 잘 결합할 수 있는가) 및 (2) affinity to BIR domain, (3) functional activity inside cell 이 모두 증가.
•
human melanoma 모델로 실험했을 때, figure 14(b)의 분자를 쓰면 2mg/kg의 적은 농도로도 efficacy를 보였다고 함.
Oligonucleotide-based approaches
•
Intuition: ON을 다른 modality와 conjugate시켜서 target과의 binding affinity를 높이자
•
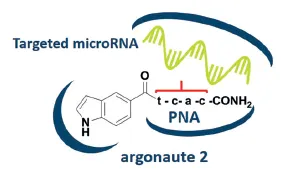
Example 1: ON의 일종인 PNA를 small molecule과 conjugate해서 dual modality binder 형성
Figure 14(c). conjugate of PNA and small molecules targeting RISC complex.
◦
PNA: peptide nucleic acid. DNA/RNA와 유사한, 인공적으로 합성된 polymer.
◦
RISC complex에서 argonaute 2 protein에 miRNA가 결합하는데, PNA-small molecule conjugte의 PNA는 miRNA에, small molecule은 argonaute protein에 결합
◦
PNA - small molecule conjugate을 miRNA122에 적용했더니, PNA만 단독으로 썼을 때보다 conjugate을 썼을 때 IC50 값이 감소했다 (1 → 100)
▪
구체적으로 뭐에 대한 IC50 값인지에 대한 설명은 없음. 이 PNA-small molecule conjugate이 RISC의 작용을 촉진하는 건지 아니면 억제하는 건지도 설명돼있지 않음
◦
의의: different modality를 결합해 new type modality를 만들 수 있으며, new type modality는 therapeutic 효과 (IC50 감소)를 가짐.
•
Example 2: peptide-DNA conjugate
◦
background:
▪
인간의 JUN 유전자에 의해 인코딩되는 c-Jun이라는 단백질이 있다 (TF)
▪
c-Jun은 c-Fos라는 전사인자(TF)와 결합해 AP-1 complex (activator protein 1, TF)를 만든다.
▪
leucine zipper region: α-helices that contain a leucine residue every seventh amino acid. c-Fos와 c-Jun에 모두 존재한다.
▪
: dissociation constant. 값이 낮을 수록 protein에 대한 ligand의 affinity가 높다
•
수식적으로는, available ligand-binding site 중 절반이 occupied되기 위해 필요한 ligand의 농도 (molar concentration)를 의미.
◦
method: c-Fos 단백질로부터 얻은 35 amino acid 길이의 peptide를 ON chain과 conjugate
▪
이 double-stranded conjugate은 c-Jun과 leucine zipper region에 동시에 결합하여 AP-1 complex의 disruption을 유발
▪
c-Jun에 대한 conjugate의 값은 360nM
•
conjugate 안 썼을 때의 값은 제시되어 있지 않음. 360nM보다 높을 것으로 예상
•
Example 3: small molecule - ON conjugate (to target mRNA)
◦
background
▪
Tau protein을 인코딩하는 pre-mRNA 내부에는 hairpin 구조가 있다
▪
Mitroxantrone이라는 항암제(small molecule)은 이 hairpin 구조에 bind한다.
◦
method: mitroxantrone과 ON (ASO) 을 conjugate시킨다
▪
이 때, hairpin 옆의 sequence에 결합하는 ON을 사용.
◦
result: synergistic effect
▪
conjugate를 쓰면 500nM의 농도만으로 complete inhibition of exon splicing 가능.
▪
mitoxantrone만 써서 같은 효과를 내려면 1 필요
▪
ASO 1만 썼을 때는 mitoxantrone 1만 썼을 때보다 효과가 낮음.
Nonpeptidic macrocycle approaches
•
macrocycle: 12개 이상의 원자로 구성되는 ring을 갖는 molecule 또는 ion
•
Intuition: 위에서 언급된 것 이외의 modality를 써보자 (e.g., nonpeptidic macrocycle)
•
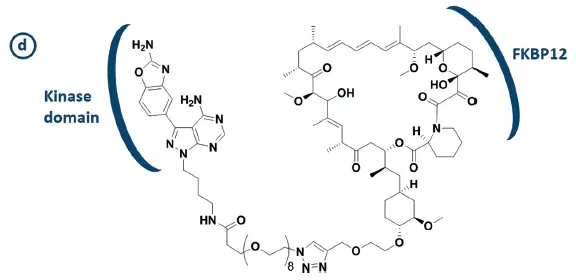
Example: rapamycin - MLN0128 conjugate (bivalent mTOR inhibitor)
◦
background
▪
mTOR: 단백질 합성, 대사 조절 세포 분화 등 다양한 세포 활동에 관여하는 단백질
▪
rapamycin과 MLN0128은 모두 mTOR inhibitor이다.
▪
rapamycin: mTOR 및 mTOR-induced-subsequent-activations를 억제하는 면역억제제
▪
MLN0128: a small-molecule kinase inhibitor
◦
motivation: 기존의 mTOR pathway inhibitor들 중 효과가 좋지 않은 것들이 있었음 → 두 inhibitor를 conjugate시켜서 bivalent inhibitor를 만듦으로써 inhibition 효과를 높이자
◦
method: construct rapamycin - (Linker (36~38 heavy atoms)) - MLN0128 conjugate
Figure 14d. 왼쪽이 MLN0128, 오른쪽이 rapamycin
◦
Result
▪
mTOR complex1, mTOR complex2의 phosphorylation을 모두 inhibit (at nM dose)
▪
MCF-7 breast cancer cell line의 성장을 억제.
▪
improved pharmacokinetic and prolonged inhibition of mTOR signaling
Further mixed modalities
Designed multiple ligands (DML) for polypharmacology
Designed multiple ligands (DML)이란?
여러 개의 biomolecular target을 target하는 약물. Multiple-target directed ligands, heterodimers, promiscuous drugs, pan-agonist라고도 함.
Proteolysis-targeting chimeras (PROTACs) for protein degradation
Proteolysis-targeting chimeras (PROTAC)이란?
Protein을 ubiquitin/proteasome system으로 유도하여 분해시키는 물질. 보통 target protein과 결합하는 ligand 부위와, E3 ligase에 결합하는 ligand 부위를 함께 갖는다.
PROTAC과 DML의 차이?
두개의 ligand를 붙여서 여러 target과 동시에 interact 하게 만드는 것은 유사하나, mode of action이 근본적으로 다르다. PROTAC은 parmacological effect를 유도한다기보다는 protein degradation을 유도함.
•
예시: Thalidomide ligand family → Cereblon (CRBN) E3 ubiquitin ligase와 결함함.
•
예시: Small molecules competitively binding to the primary HIF-binding site on von Hippel-Lindau (VHL) E3 ligase
Novel approaches to multimeric mixed modalities
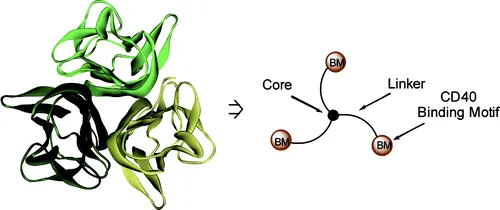
Synthetic antibody mimics for targeted delivery
Synthetic antibody mimics (SyAMs)란?
Antibody의 (1) 특정 target에 결합하고, (2) 그 target 혹은 target을 발현하는 cell을 제거하는 기능을 모방하는 물질
•
예시) Prostate-specific membrane antigen (PSMA)에 결합하는 glutamate urea motif와 Fc gamma receptor I (FCRI)에 결합하는 cyclic peptide를 함께 가지는 물질. → immune cell을 prostate cancer cell로 유도하여 immune response를 유도한다.
•
Antibody와 비슷한 기능을 하지만 분자량이 그 5%에 불과하다.
Multimeric ligands to mimic protein complexes or to oligomerize proteins
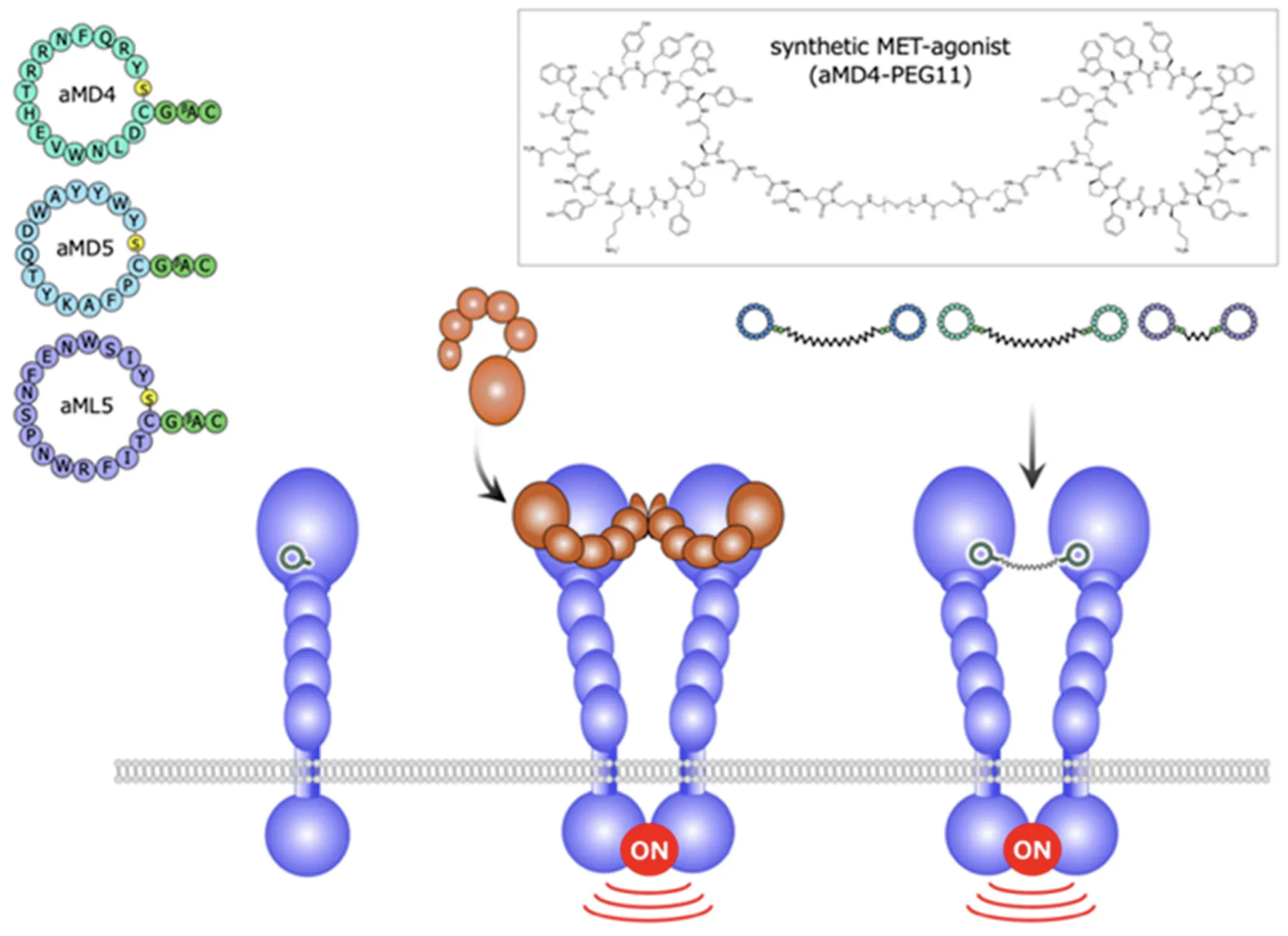
Multimeric ligand의 효과?
여러 protein이 결합된 large protein complex를 모방할 수 있고, 혹은 ligand에 결합하는 단백질들을 불러모아서 biological process를 조절할 수 있다.
CD40L trimer 구조
Trimeric CD40L mimetics
Synthetic MET agonist. HGF receptor (Met)의 dimerization을 유도함.
Dendrimer conjugates for targeted delivery
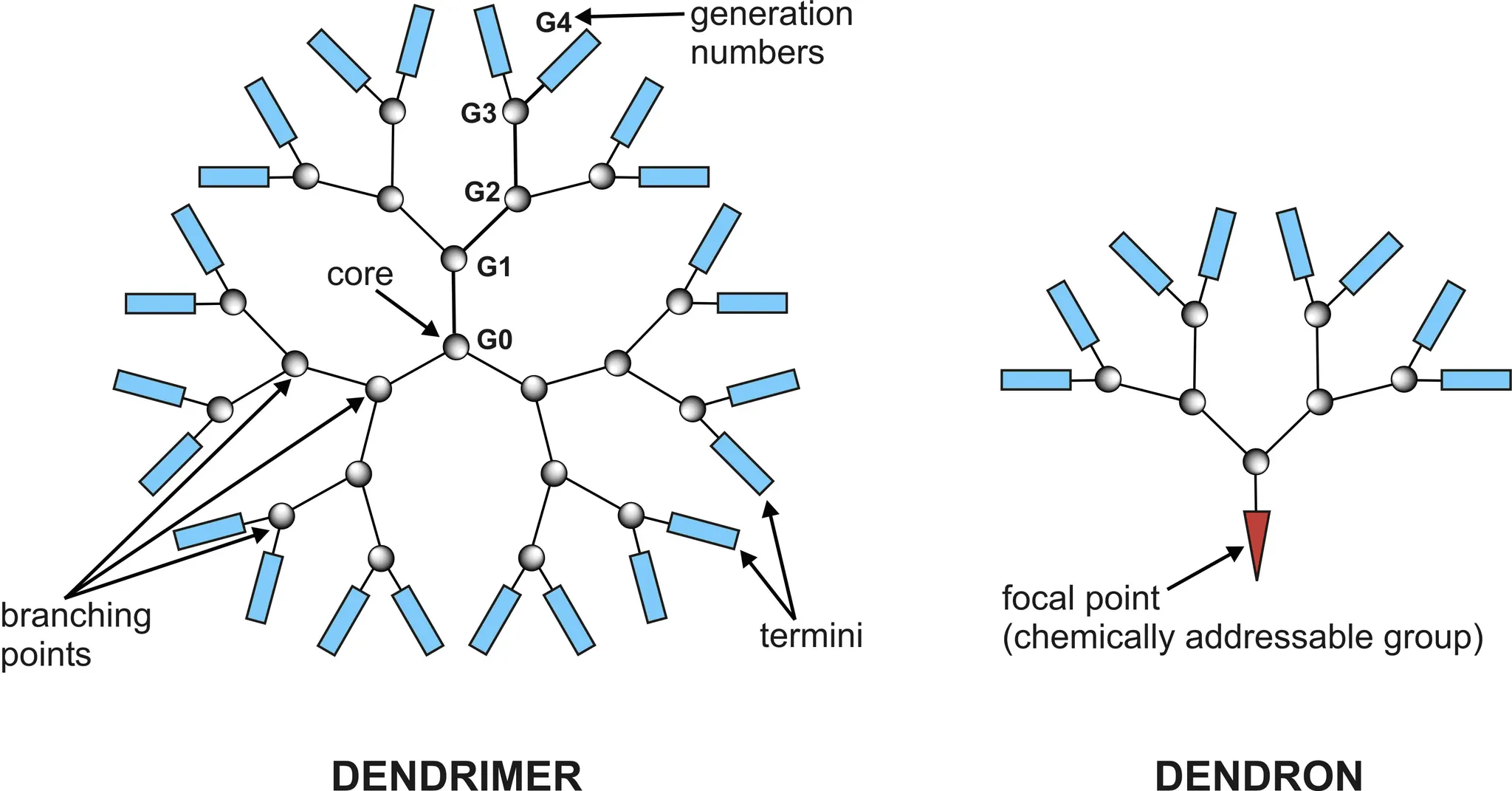
Dendrimer란?
매우 질서화되어있고 규칙적 가지 구조를 가지고 있는, 구형의 거대분자. 표면(가지 끝부분)을 화학적으로 변형시킬 수 있는 platform으로써 활용 가능하다.
•
Antitumor small molecule (e.g., doxorubicin, cabazitaxel, docetaxel)들이 붙은 dendrimer conjugate들이 현재 임상 1상 중이다.
•
Peptide-decorated dendrimers (PDDs): Peptide-targeting motif를 붙여서 암세포로 유도
•
양이온들이 붙은 dendrimer들은 음이온들이 붙은 dendrimer들보다 toxic하다. 아마도 cell membrane의 electrostatic interaction들을 destabilizing하기 때문으로 보인다.
Summary and perspective on mixed modalities
•
위에서 언급된 다양한 mixed modality들은 drug delivery에 사용될 수 있는 potential이 높다.
◦
기존에는 타겟팅이 어려웠던 세포/조직에 약물을 잘 전달할 수 있다.
◦
동일한 therapeutic target에 작용하는 서로 다른 modality들을 결합함으로써 synergistic binding affinity를 얻을 수 있다. (예시: PNA - small molecule conjugate, targeting RISC)
•
고려해야 할 점들
◦
conjugation method: conjugation method에 따라 release strategy(drug molecule을 세포 내에서 어떤 방법으로 release할지)
◦
drug molecule을 release하는 과정에서 생기는 부산물들이 cell toxicity를 띠는 경우, 이를 조절할 수 있어야 함.
◦
cell permeability: mixed modality가 permeable해야 한다.
▪
이는 비단 mixed modality에만 한정되지 않음. single modality에서도 중요함.
◦
fusion modality: 만들고자 하는 fused molecule of two modalities가 자연적으로 존재하는 물질이 아닐 수도 있다.
◦
mixed modality가 약물일 경우, 이 약물이 경구투여 가능한가? (oral delivery)
▪
oral delivery는 가격, 편리성 등의 이유로 가장 흔히 사용되는 drug administration 방법.
Summary and outlook for new modalities
•
combination of different modalities: hybrids의 개념이 생물학 분야로 확장된 것이라 볼 수 있다.
◦
서로 다른 chemical space로부터 만들어지는 두 modality의 결합은 integration of different chemical spaces라고도 볼 수 있음.
◦
각 modality의 성능을 따로따로, 혹은 synergistically 높임으로써 target을 더 잘 조절.
•
approaches to find hit molecule
◦
(1) random screening
▪
단점:
•
modality의 개수가 많을 수록 library size가 점점 커진다. → library가 커질 수록, 실제로 필요한 compound-of-interest를 random choice로 찾을 수 있는 확률이 점점 낮아져서 문제가 되는 것으로 이해했음.
◦
여기서의 library는 library of individual compounds. bag-of-words의 chemical version이라고 생각하면 될 듯. (word → compound)
•
combination of two modalities를 할 경우, complexity가 증가하여 결과적으로 더 좁은 영역의 chemical space만 보게 된다.
→ 각 modality마다 focused library를 screen할 수 있는 방법이 필요.
◦
(2) Directed synthesis and screening
▪
phage display의 원리와 비슷하다.
•
phage display: protein-of-interest를 인코딩하는 gene이 박테리오파지의 phage coat protein gene으로 insert됨 → 박테리오파지의 표면에 protein-of-interest가 노출됨 → 박테리오파지의 표면에 나타나는 단백질과 다양한 peptide/DNA/protein 등 간의 상호작용을 연구
▪
다양한 상호작용들을 test → new modality starting point를 더 잘 찾을 수 있다.
◦
(3) use structural information (molecular modelling)
▪
단백질의 2차 혹은 3차 구조를 mimic
▪
initial starting point를 먼저 찾은 후, 다른 modality와의 combination들을 통해 가장 적합한 hybrid를 찾음 (evolve and optimize)
▪
장점: new modality starting point를 빨리 찾을 수 있다
▪
단점: structural information이 밝혀져 있는 화합물, 또는 robust homology model이 있어야 함.
•
Challenges
◦
(1) 원하는 target과 결합하는 new modality를 만들 수 있는 hit molecule을 찾는 게 어려움
◦
(2) cell permeability: 만들어진 modality가 high molecular weight을 갖는 화합물일 경우, 세포 내로 투과시키기가 더 어려워짐.
▪
modality의 cell permeability를 측정하는 방법들 (세포 내로 얼마나 많이 들어갔는지)
•
(a) modality를 fluorescently label한 뒤 FACS 사용
◦
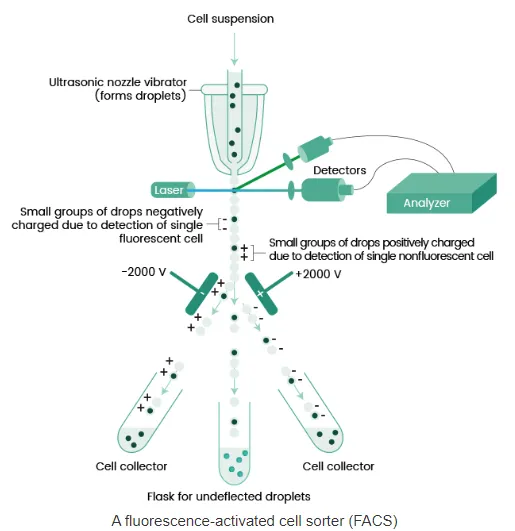
FACS: Fluorescence-activated cell sorting.
▪
세포의 수를 측정하는 cytometry, 특히 flow cytometry 기법 중 하나
▪
여러 종류의 cell들의 혼합액의 flow를 가지고 개별 cell의 fluorescence intensity 를 측정. fluorescent cell과 nonfluorescent cell에 각각 반대 종류의 전하를 걸어줘서 fluorescent cell과 nonfluorescent cell을 서로 다른 cell collector로 분류.
▪
단점: fluorescence tagging이 없으면 세포의 수를 셀 수 없음
•
(b) Novel approaches (under development)
◦
mass spectrometry (질량 분석)에 기반한 방법
◦
Raman spectroscopy (especially, without tagging)
▪
Raman spectroscopy: 라만 분광법. 특정 분자에 레이저를 쏘았을 때 그 분자의 전자의 에너지준위의 차이만큼 에너지를 흡수하므로, 여러 종류의 분자에 동일한 빛을 투과시키면 분자의 종류에 따라 산란되어 나오는 빛의 파장이 다르다.
▪
laser light (주로 가시광선, 근적외선, 근자외선)을 분자에 쏘면 laser light이 molecular vibration, phonon 등과 상호작용하여 laser photon의 에너지가 더 높아지거나 낮아지고 (energy shift), 이걸 통해 분자의 vibrational mode를 알 수 있다. (https://en.wikipedia.org/wiki/Raman_spectroscopy#Raman_shift)
◦
(3) conjugate가 어떤 원리로 세포 내로 유입되는지 (internalization, membrane trafficking)에 대한 더 깊은 이해가 필요.
▪
예를 들어, cargo (drug)가 endosome을 escape하는 원리는 아직도 많이 밝혀지지 않음
▪
tagging을 하지 않고도 subcellular localization을 할 수 있는 기술이 개발돼야 함.
▪
이를 위해서는 서로 다른 분야 간의 collaboration이 필요
•
ex) medicine chemistry and formulation science
▪
최근 개발 중인 NanoSIMS imaging이라는 기술은 stable isotope만 사용하여 50nm의 resolution으로 subcellular localization을 할 수 있다.
▪
(참고) membrane trafficking: cargo가 세포막에 붙어있는 transport vesicle을 이용해 세포막을 통과하는 것 (endocytosis, exocytosis 모두 포함)
◦
(4) new modality를 디자인할 수 있을 만큼 충분한 지식을 쌓는 것 ← 제일 큰 challenge
▪
Needs closer collaboration between industry and academia.
•
Summary
◦
new modalities를 사용해 complex target들을 더 잘 조절할 수 있다.
◦
novel ideas and approaches which can overcome current challenges are needed.
Glossary
용어 | 약자 | 설명 |
Cell-penetrating peptides | CPP | short peptides (< 30 amino acids). 자기 자신을 세포 외부에서 내부로 translocate 시킬 뿐만 아니라, 자기 자신과 conjugate되어 있는 drug (or cargo) 또한 translocation 시킨다.
(출처: https://www.frontiersin.org/articles/10.3389/fphar.2020.00697/full) |
Biologics | Biologic drugs contain components from living organisms such as humans, plants, animals, and microorganisms.
https://www.pfizer.com/news/articles/biologics_vs_biosimilars_understanding_the_differences | |
Proteolysis targeting chimeras | PROTACs | Protein을 ubiquitin/proteasome system으로 유도하여 분해시키는 물질. 보통 target protein과 결합하는 ligand 부위와, E3 ligase에 결합하는 ligand 부위를 함께 갖는다. |
Oligonucleotides | ONs | Short DNA or RNA fragment (단일가닥, 이중가닥 모두 포함. 길이는 보통 13~25 nucleotides이지만 이것보다 더 길 수도 있음) |
Antisense oligonucleotides | ASOs | 보통 16-20bp 길이의 안정한 single strand nucleotide. Target RNA 서열에 상보적으로 결합한다.
Target RNA는 mRNA 일수도 있고, 반대로 miRNA 일수도 있다. (anti-miRNA) |
Modified mRNAs | modRNAs | ON의 일종. ASO 및 siRNA와는 반대로, translation을 촉진한다. |
Aptamers | Aptamers are single-stranded ONs that form stable 3D structures.
Bind with high affinity and specificity to a variety of molecular targets, including proteins, and hence modulate their function. | |
Small interfering RNA | siRNA | 20~24 bp 길이의 이중 가닥 RNA. 두 가닥 중 guide strand가 RISC complex에 결합하여 target mRNA의 분해를 유도함으로써 유전자 발현을 억제. |
Short hairpin RNA | shRNA | 두 상보적인 oligonucleotide strands를 loop를 이루게 link한 것으로 (hairpin 구조), shRNA가 dicer에 의해 processed되어 siRNA가 만들어짐 |
Dendrimers | ||
Peptide-decorated dendrimers | PDDs | |
Phosphorodiamidate morpholino oligomers | PMOs | |
Peptide nucleic acids | PNAs | peptide nucleic acid. DNA/RNA와 유사한, 인공적으로 합성된 polymer |
2’,4’-constrained MOE ONs | cMOE ONs | |
Constrained ethyl ONs | cET ONs | |
RNase H | RNA-DNA hybrid의 RNA 만을 특이적으로 분해하는 효소. | |
Gapmers | ASO의 일종. 양쪽 끝의 nucleotide sugar 2번 탄소들은 변형되어 있어 nuclease에 의해 잘 분해되지 않는다.
반면 central gap 지역의 nucleotide는 unmodified sugar를 가져서, RNase H가 이 지역을 target 하여 mRNA를 분해할 수 있도록 한다. | |
Antibody-drug conjugates | ADCs | antibody + linker + payload to be delivered로 구성됨.
Antibody: homing peptide (cargo/drug를 target cell까지 데려가는 peptide)
Linker: antibody와 payload (e.g., drug)을 연결시켜주는 분자
Payload: A molecule which should be delivered into target cell or tissue (could be ON drug, or any other molecule-of-interest)
(Reference: https://broadpharm.com/blog/what-are-adc-linkers) |
Random nonstandard peptide integrated discovery | RaPID | |
Split-intein-mediated circular ligation of proteins and peptides | SICLOPPS | |
Hydrocarbon-stapled peptides | ||
Bicyclic peptides | Bicycles are formed by constraining short linear peptides into a stabilized bi-cyclic structure using a central chemical scaffold.
https://www.bicycletherapeutics.com/approach/therapeutic-modalities/ | |
Ring-closing metathesis | RCM | |
pri-miRNA | Primary miRMA.
DNA로부터 전사되어 만들어진, miRNA의 최초 전사체.
Hairpin 구조를 갖고 있으며 5’ 말단에 cap 구조 및 3’ 말단에 poly A tail을 가지고 있다. | |
pre-miRNA | Precursor miRNA.
pri-miRNA가 Drosha 및 DGCR8 단백질들에 의해 절단되어 만들어진 short hairpin structure. | |
mature miRNA | pre-miRNA가 exportin 및 RanGTP 단백질들의 작용으로 인해 cytoplasm (세포질)로 이동한 후, Dicer 및 TRBP 단백질들의 작용으로 인해 hairpin구조가 절단되어 이중가닥 구조만 남는다.
이 이중가닥 중 하나는 guide strand, 다른 한 쪽은 passenger strand라 하는데, 이중가닥 상태에서 두 개의 single-strand로 분리된 후 passenger strand는 분해되고, guide strand는 약 22 nucleotide 정도의 길이만 남는다. 이것을 mature miRNA라 한다.
Mature miRNA는 RISC complex의 일부분으로 작용하여 gene expression을 억제한다. 구체적으로는, RISC complex 안에 있는 miRNA가 target mRNA에 상보적으로 결합하여 target mRNA의 분해를 유도하거나 번역을 중지시킨다. | |
RNA-induced silencing complex | RISC | A multiprotein complex which, when combined with a single strand of siRNA or miRNA (template), targets mRNA which is complementary to the template to induce the degradation of target mRNA. This whole process is called RNAi (RNA interference)
https://link.springer.com/referenceworkentry/10.1007/978-1-4419-9863-7_329 |
Synthetic antibody mimics | SyAMs |
•
miRNA의 biogenesis 과정에 대한 자세한 설명
(1) https://www.frontiersin.org/articles/10.3389/fgene.2012.00305/full 의 Figure 1
(2) https://www.bioin.or.kr/board.do?num=213923&bid=tech&cmd=view